
PD-L1 通常被认为是一种大小为 40 kDa 的Ⅰ型跨膜蛋白,可以与 PD-1 相互作用。
PD-L1 在几乎所有的肿瘤细胞表面过表达,肿瘤细胞可通过其表面表达的PD-L1,与T细胞表面PD-1受体结合,经过细胞内信号传递,抑制T细胞功能,导致肿瘤细胞免疫反应受损及对常规放化疗的抵抗。
近期有研究表明 PD-L1 可以通过内吞与核质转运途径从质膜转移到细胞核中,并调控免疫反应基因表达,参与肿瘤细胞的多种恶性表型。
本文将从胞内 PD-L1 与 DNA 损伤修复、细胞自噬、细胞凋亡、肿瘤转移的关系,阐述胞内 PD-L1 与肿瘤发生及进展的关系,并简要介绍靶向胞内 PD-L1 策略方法的研究进展。
一、胞内 PD-L1 与 DNA 损伤修复
胞内PD-L1可以结合并稳定DNA损伤反应(DDR)相关基因的 mRNA,以促进 DNA 损伤修复。
近期研究表明胞内 PD-L1 可以结合 DNA 修复元件 BRCA1 和 NBS1 的 mRNA,增强 mRNA 的稳定性,从而提高细胞对于 DDR 的抵抗能力。
这种结合 mRNA 的能力所依靠的是 PD-L1 的细胞内结构域,而不依赖于 PD-L1/PD-1 的结合,是一种独立于免疫调节的功能。
另外,研究人员还发现在胞内 PD-L1 表达极低的细胞系中,PD-L1 水平不足以保护细胞免受 DNA 的损伤,可以间接反映细胞内 PD-L1 在 DNA 的损伤修复中发挥了重要的作用。
值得注意的是,除了 DDR 相关基因外,作者还观察到胞内 PD-L1 与细胞周期、代谢、转录和蛋白质修饰等重要通路分子的 mRNA 稳定性也有一定相关性。这提示胞内 PD-L1 还有可能参与这些细胞事件的调控。
有趣的是,不单是细胞内的 PD-L1 可以调控 DDR,反过来,DNA 损伤水平和 DDR 也可以上调 PD-L1 的表达。例如,卵巢肿瘤的氧化 DNA 病变是一种持久性 DNA 损伤形式,其程度的增加会使肿瘤中 PD-L1 的表达也随之增加,但该现象的机制尚不完全清楚。
相类似的,药物所诱导的 DNA 损伤可上调肿瘤细胞 PD-L1 的表达。在溃疡性结肠炎,免疫细胞诱导的炎症激活 DNA 双链断裂/干扰素调节因子-1 途径可以诱导 PD-L1 的表达上调。
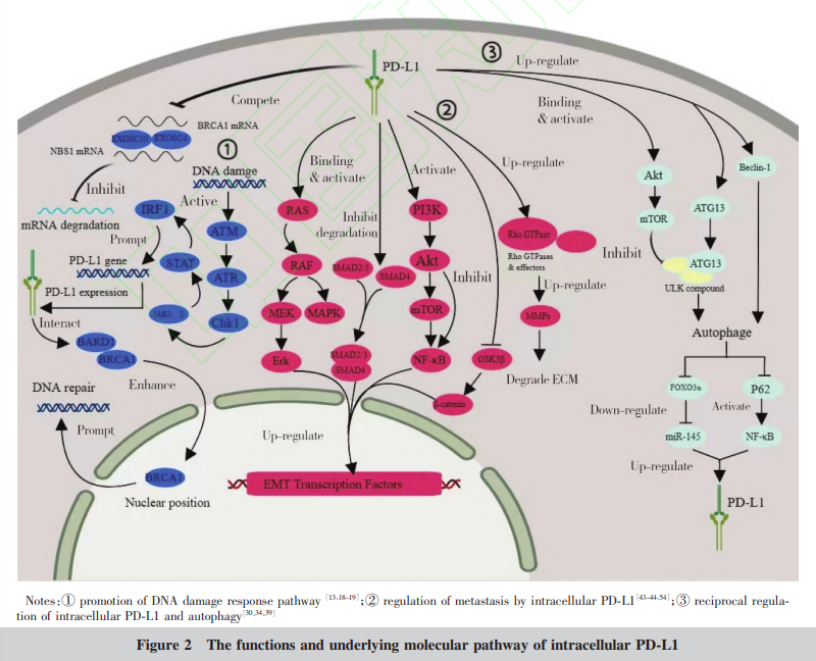
综上,DNA 的损伤修复会激活 PD-L1 表达,而 PD-L1 又可反过来提高 DNA 修复元件的稳定性并通过多种途径提高 DNA 抗损伤能力。
这说明 PD-L1 对于 DNA 的损伤修复存在正向的作用,所以可以在抑制 DDR 的同时联用抗 PD-L1 的药物,以此达到更好的抗肿瘤效果,为临床的肿瘤治疗提供新思路。
二、胞内 PD-L1 与细胞凋亡
有研究显示,胞内PD-L1具有促进细胞凋亡的作用。
如人结肠癌细胞中,癌基因BRAFV600E可以增强c-JUN和YAP的活性,然后通过MAPK信号通路上调PD-L1的表达,诱导BIM、BIK表达,以增强化疗诱导的细胞凋亡,而PD-L1的缺失可以抑制BIM和BIK,减轻多种抗癌药物诱导的细胞凋亡;
HNRNPL和PD-L1的水平成正相关,干扰HNRNPL或抗PD-L1的治疗都可抑制结直肠癌的增殖,并促进其细胞凋亡;
低剂量山药苷-B可以通过肿瘤固有的PD-L1-NLRP3信号通路,下调PD-L1的表达,激活顺铂耐药的胃癌细胞中由NLRP3介导的细胞焦亡。
除了上述促进凋亡的作用以外,胞内PD-L1还有抑制细胞凋亡的作用。
有研究报道,敲除人和小鼠CRC细胞系中的PD-L1可以抵抗各种细胞毒性药物诱导的凋亡,从而促进肿瘤在细胞毒性化疗后存活等。
可见,不同的PD-L1表达水平和不同类型肿瘤细胞,对于凋亡的敏感性变化也不相同,原因可能是PD-L1的水平改变作用的通路不相同,或作用于相同通路但产生的效应不同。
已证明,在PD-L1上调的操作后,乳腺癌、小细胞肺癌和淋巴瘤细胞对化疗诱导的凋亡具有较强的抵抗能力;而在人结肠癌细胞、人RKO、小鼠B16F10黑色素瘤细胞和小鼠MC38结肠癌细胞中则需要在PD-L1下调的操作下才具有凋亡的抵抗能力。
三、胞内 PD-L1 与细胞自噬
自噬是肿瘤细胞的一种生存策略,在恶劣条件刺激下,如DNA损伤、营养缺乏、缺氧、破坏性刺激等情况下,肿瘤细胞的自噬会被激活以应对压力、促进生存。
研究表明,胞内PD-L1与肿瘤细胞自噬可相互调控,胞内PD-L1可调控细胞自噬过程,反过来,细胞自噬也可影响PD-L1的表达。
01 胞内PD-L1调控自噬
多项研究表明,胞内 PD-L1 与肿瘤细胞的自噬相关,值得注意的是,胞内 PD-L1 对不同肿瘤细胞的自噬有着不同的影响。
Zhang 等的研究发现,PD-L1 敲除会抑制膀胱癌细胞在饥饿刺激下的自噬 流,说明 PD-L1 会促进膀胱癌细胞的自噬。
Gao 等的研究发现 PD-L1 也可促进卵巢癌细胞的自噬,机制是通过上调参与自噬调节的关键分子 Beclin-1 的表达。
PD-L1 还可以通过增加 ATG13 的表达诱导肝癌细胞的自噬。
但是,在 Chen 等的研究中,作者发现胞内 PD-L1 可以通过与 AKT 结合并促进其激活来抑制胶质瘤细胞自噬。
不难看出,胞内 PD-L1 对于自噬的影响似乎有着肿瘤特异性。
02 自噬调控 PD-L1 表达
细胞自噬也可调控 PD-L1 表达,且不同研究的结论不一甚至相反。
在 Tsai 等的研究中,膀胱癌细胞自噬水平与 PD-L1 表达呈负相关,即低自噬活性的肿瘤细胞表现出更高的 PD-L1 表达。
进一步研究发现阻断自噬可通过激活 ERK-JNK-c-Jun 信号,同时抑制 miR-34a的表达,最终上调膀胱癌细胞中 PD-L1 的表达。
Wang 等在对胃癌的研究中发现,自噬可以通过 p62/SQSTM1-NF-κB 通路调节胃癌细胞中 PD-L1 的表达,且通过药理学或 RNA 干扰的方法抑制自噬,可以诱导 PD-L1 的表达,而药物激活自噬则降低了 PD-L1 的表达。
相似的结果在对一些细胞内受体如 PPARγ、抗肿瘤药物如维替泊芬、苏尼替尼、辛可宁的研究中也有提到。
这几项研究说明,抑制自噬可以在不同细胞内通过不同的信号通路诱导 PD-L1 的表达,说明自噬抑制 PD-L1 表达。
但也有结果相反的报道,Zhu 等的研究发现自噬也可以提高 PD-L1 水平,这是作者所研究的一整条正反馈回路的一个部分。
肿瘤细胞内的 PD-L1 与自噬有着复杂的相互关系。PD-L1 与自噬活动的相互作用与多种信号通路及分子有关,而且似乎存在着细胞特异性。故难以 将 PD-L1 与自噬之间的关联归纳为普适、统一的机制。
四、胞内 PD-L1 与肿瘤转移
研究表明,在众多不同种类肿瘤中,胞内 PD-L1 都可增强肿瘤细胞转移能力。
其影响机制大多与上皮间质转化(EMT)以及基质金属蛋白酶(MMPs)有关,此外 PD-L1 通过影响自噬也能增强肿瘤细胞的转移。
EMT 对于肿瘤迁移侵袭有着重要意义,常伴有几个关键分子的表达变化,如 E-cadherin 表达下调,N-cadherin 上调,Slug、Snail、Twist 等 EMT 相关转录因子活化。
现今已证明在多种肿瘤细胞中,PD-L1 可通过 EMT 信号通路促进 EMT 进程,进而促进细胞转移,如卵巢瘤、下咽鳞状细胞癌等。
Fei 等发现在鼻咽癌中,PD-L1 可以通过激活PI3K/Akt/mTOR 信号通路,促进 EMT 进程;
除了经典通路外,PD-L1 还被发现能通过其他方式影响细胞 EMT 表型,如在肺癌中,PD-L1 除能够激活 PI3K/ Akt/mTOR 信号通路之外,还能够促进 β-catenin 与 wip 启动子上的 LEF/TCF 位点结合,上调 WIP 表达,经由 WIP 与 RhoA 相互作用促进肿瘤细胞 EMT 进程;
而在三阴乳腺癌和头颈部癌中发现,PD-L1 可通过抑制 Snail 降解来促进 EMT 进程,而非常见的上调 Snail 表达的方式。
这些证据表明了 PD-L1 可通过多种途径促进 EMT 进程,进而促进肿瘤转移。PD-L1 这一促进 EMT 的作用极大影响了肿瘤治疗的研究。
但值得注意的是,对于部分不同类型的肿瘤细胞,PD-L1 的作用机制也存在不同。因此,在选择治疗药物时需充分考虑不同肿瘤细胞中 PD-L1 是否存在不同的影响机制。
细胞迁移侵袭是恶性肿瘤致病致死的一个重要原因。鉴于对肿瘤细胞转移的促进作用,PD-L1 可能作为一个抑制肿瘤侵袭转移的靶点。
但目前研究表明,在不同种类肿瘤中,PD-L1 影响肿瘤细胞转移能力的机制亦不同,且其背后原因仍待探究,因此在联合策略上应当视具体情况而定。
五、靶向胞内 PD-L1 的策略
目前获得批准应用临床的 PD-L1 抗体是通过阻断细胞外 PD-1/PD-L1 结合来治疗癌症,对比放疗、化疗、手术等传统方法,其不良反应更少,可以诱导晚期和转移性肿瘤消退和提高患者生存率,作用持久,适用于多种癌症类型,尤其是实体瘤。
迄今为止,全球共有 10 种批准的 PD-1/PD-L1 抗体,涉及 17 种不同的癌症类型,然而这一系列抗体都是阻断细胞外 PD-1/PD-L1 结合,却不影响胞内 PD-L1 的表达。
鉴于胞内 PD-L1 参与肿瘤恶性表型的调控,靶向抑制胞内 PD-L1 也将是一种有效的肿瘤治疗方法。胞内 PD-L1 可以稳定 DDR 相关基因 mRNA 促进肿瘤细胞对化疗和放疗抵抗,因此将有可能成为提高肿瘤放化疗敏感性的靶点。
01 PD-L1 胞内抗体 H1A 破坏 PD-L1 的稳定性并使癌症对放射治疗敏感
临床批准的 PD-L1 抗体 Durvalumab 和 Ate-zolizumab 在细胞外结合 PD-L1,从而消除 PD-L1/ PD-1 检查点,并不影响 PD-L1 或 NBS1 的表达,因此要开发新的靶向 PD-L1 胞内结构域的抗体。
研究者发现H1A不仅可以破坏活化 T 细胞中的 PD-L1 功能,引起 PD-L1 的下调,而且还降低了 NBS1 的 mRNA 和蛋白质水平。
已知 CMTM6 可以保护 PD-L1 免受溶酶体降解。H1A 以溶酶体依赖性方式阻断 PD-L1/CMTM6 相互作用,促使 PD-L1 降解,从而抑制了 PD-L1 稳定 NBS1 mRNA 作用,导致细胞对 DNA 损伤更敏感。
而 FDA 批准的 PD-L1 抗体 Durvalumab 不影响 PD-L1 和 CMTM6 之间的相互作用。 在免疫缺陷小鼠中,H1A 联用放疗与 Durvalumab 联用放疗相比,H1A 联用放疗更显著抑制肿瘤生长。
综上所述,H1A 通过下调 PD-L1 并抑制其在 DDR 中的作用来使癌症对 DNA 损伤疗法敏感。
02 胞内 PD-L1 其他可能的靶点
已知 IFN 具有抗肿瘤作用,在抗癌免疫反应中发挥着关键作用,并有助于常规治疗和免疫治疗的疗效。
PD-L1 通过其胞质内结构域的信号转导抵抗 IFNβ 细胞毒性,从而保护癌细胞免受 IFNβ 毒性。
为了进一步研究 PD-L1 胞内结构域的其他可能的靶点,故深入了解胞内 PD-L1 参与 IFNβ 介导的细胞毒性作用过程的具体序列。只有序列 EKCGVEDTSSKNR 与 DNA 介导的 RNA 聚合酶亚基 β 中的一个结构域高度相似。
若在后续研究中,可以进一步确定 RMLDVEKC 整个序列的晶体结构,再人工合成选择性抑制剂,抑制其减毒作用,这样以后治疗肿瘤时就可以增强 INFβ 的细胞毒性,从而杀伤肿瘤细胞。
或者进一步研究如何增加 DTSSK 序列的表达量,增强 INFβ 介导的细胞毒性,抑制癌症进一步发生发展。
有些细胞内 PD-L1 介导的癌细胞内信号通路,不会受到抗 PD-L1 抗体的影响。这意味着,设计新的方法来靶向癌细胞内的 PD-L1 信号可能辅助抗 PD-L1 抗体,疗效更强,副作用更少,预后更好。
综上所述,胞内 PD-L1 能够影响胞内信号转导或进入核内调控靶基因转录,通过非免疫检测点功能广泛参与肿瘤细胞的恶性进程,如调控肿瘤细胞 的 DNA 损伤修复、自噬和迁移侵袭能力。
根据临床研究,联用 PD-L1 核转移抑制剂和胞内 PD-L1 靶向抗体可增强肿瘤治疗的疗效,在未来它或许可用于癌症治疗。
研究中发现胞内 PD-L1 还能触发其他免疫检查点分子的表达,而这些分子并不是 PD-1/PD-L1 阻断的靶点,这表明 PD-L1 还可能调控许多肿瘤细胞恶性表位的表达,但是目前其机制还尚不清楚。在未来的研究中,我们可以研究其表达途径,并将其靶基因作为未来的治疗靶点。
