自19世纪中叶德国病理学家提出肿瘤起源于慢性炎症这一假说后,炎症与肿瘤的关系受到国内外学者的高度重视。
炎症与肿瘤有着千丝万缕的联系,根据流行病学研究结果发现高达15%肿瘤的发生、发展与感染引起的炎症有关。
癌症相关性炎症
炎症是机体应对感染和组织损伤的适应性反应,以血管反应、免疫细胞的募集和分子介质的释放为主要特征。
炎症反应的主要目的是对抗病原体或有害刺激、修复损坏的组织以及恢复体内平衡。若炎性刺激长期存在或炎症调控机制失控将导致一系列的疾病,如自身免疫疾病、组织纤维化以及癌症。
癌症与炎症的相关研究在早期主要着眼于炎症的促癌作用,如在肝癌中炎症可直接促进肿瘤细胞增殖与存活,并通过影响免疫调控使得肿瘤逃逸免疫系统的监视。此外,炎症还可以诱导血管生成以及基因组不稳定性来促进肿瘤发展。
肿瘤释放的生长因子和肿瘤微环境通过激活磷脂酰肌醇-3-羟激酶(PI3K)和丝裂原激活的蛋白激酶(MAPK)信号通路,促进HIF-1α合成。
肿瘤相关巨噬细胞(TAMs)在肿瘤低氧区域激活 HIF-1α 后诱导肿瘤细胞表达程序性死亡配体-1(PD-L1),抑制细胞毒性淋巴细胞(CTL)活性。因此, HIF-1是多数进展期肿瘤激活转录因子/信号通路和直接控制炎症反应的良好例证。
IL-1和IL-6等细胞因子促进癌变细胞的存活,克服癌基因诱导的衰老并促进TME的重塑、肿瘤进展和耐药。
抑癌基因p53的缺失可引起炎性细胞因子过表达,驱动肿瘤侵袭和转移或协助克服致癌性转化诱导的衰老。
癌症相关性炎症与肿瘤微环境的相互作用
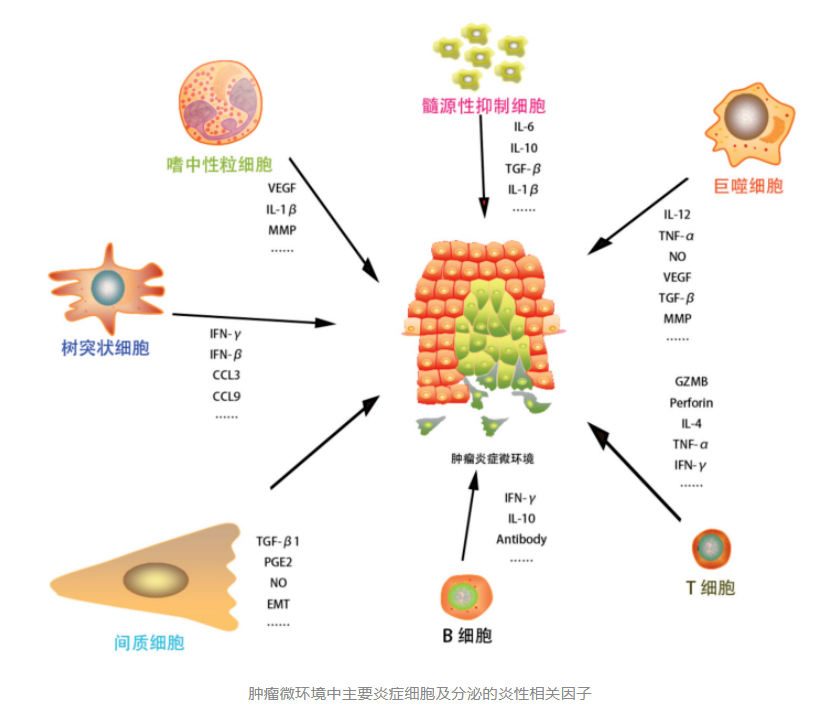
TME即肿瘤细胞产生和生活的内环境,其中不仅包括了肿瘤细胞本身,还有其周围的成纤维细胞、免疫和炎性细胞、胶质细胞等各种细胞,同时也包括附近区域内的细胞间质、微血管以及浸润在其中的生物分子。
01 促炎性细胞因子网络在肿瘤微环境中的作用
免疫细胞、癌细胞和基质细胞在 TME 中构成了复杂的调控网络。在这个复杂的网络中,通过彼此诱生、受体调节以及发挥生物效应等方式相互影响。
细胞因子由成纤维细胞和内皮细胞等合成,依赖于TME调节细胞增殖、存活、分化、活化、迁移和死亡。免疫细胞分泌的细胞因子也是肿瘤炎性反应 的直接调节介质,不同因子互相作用诱导免疫细胞和肿瘤细胞发生功能变化,形成动态变化中的、复杂的TME,引发肿瘤恶性增殖及侵袭、转移等生物学行为。
癌症中常同时发生免疫刺激和免疫抑制,巨噬细胞移动抑制因子(MIF)、肿瘤坏死因子-α(TNF-α)、IL-6、IL-8、IL-10、IL-18、和 TGF-β 等细胞因子同时增加。趋化因子通过向癌细胞发出信号和重构局部微环境促进肿瘤生长和侵袭,增加转移性病灶;另一些淋巴因子下调,则增强CTL活性 并抑制肿瘤细胞生存,进而延缓肿瘤进展。此外, 肿瘤特异性以及非组织学依赖的细胞因子级联反应还可能是潜在的副肿瘤性全身性疾病的表现之一。
既往研究表明,IL-6、IL-8、IL-10、IL-18、和TGF-β等多种细胞因子上调炎症反应为癌症进展不可或缺的因素。特别是部分细胞因子可以激活 NF-κB 和 STAT家族转录因子,进而与肿瘤“分泌蛋白质组”的其他成分将炎性环境、肿瘤和免疫细胞联系起来,并通过对生存因素的控制和调节TME直接促进肿瘤的形成与进展。
02 免疫编辑和免疫逃逸中的关键细胞因子网络
在分子水平,TGF-β、Th2 细胞因子(包括 IL-4、 IL-5、IL-6、IL-10、IL-12和IL-13)、趋化因子(尤其是血管生成趋化因子)、VEGF、炎性因子和粒细胞-巨噬细胞集落刺激因子(GM-CSF)等均在肿瘤逃避免疫监视的过程中扮演重要角色。
1、转化生长因子(TGF-β)
TGF-β信号在致癌过程中被称为“双刃剑”,因其在正常上皮细胞或者肿瘤发生早期可抑制肿瘤;但随着肿瘤的发展,TGFβ信号也可促进晚期肿瘤进展以及转移。
TGF-β 直接抑制自然杀伤细胞(NK)、巨噬细胞和CTL的杀伤活性,并能抑制NK细胞和CTL的克隆增殖。
2、Th2炎性细胞因子
由Th2分泌的细胞因子主要包括IL-4、IL-5、IL-6及IL-10等,主要功能为刺激B细胞增殖并产生IgG,IgE抗体,在体液免疫过程中发挥着重要作用。
机体正常时,Th1和Th2细胞功能处于动态平衡状态,但当机体接触抗原后,Th1和Th2 细胞中某一亚群功能升高,另一亚群功能降低,该现象即为Th1/Th2漂移。
由于Th1与Th2分泌的细胞因子不同,因此Th1/Th2漂移会引起体内细胞因子浓度的变化。
3、血管内皮生长因子(VEGF)
血管生成因子VEGF-A也具有抑制免疫的功能。VEGF-A实际上是第一个被确认能抑制DCs成熟的细胞因子。而 VEGF信号更是一种与肿瘤促进炎症及血管生成相关的关键因素。
VEGF通过VEGFR2 有促炎性细胞因子的释放的自分泌效应,可诱导内皮 细胞(非白细胞)中的 IL-6、IL-8/CXCL8 和 GRO-α/ CXCL1 分泌增加;相反 TNF-α、IL-1β、IL-6 和 IL-8/ CXCL8等炎性细胞因子可以诱导VEGF的表达。
在TME中缺氧不仅会诱发免疫抑制还能够诱发血管生成和炎症。炎症和血管生成细胞因子表达之间的协调和相互强化可通过低氧诱导和NF-κB信号通路连接 VEGF和COX2。
靶向肿瘤炎症反应与肿瘤治疗
鉴于炎症及炎症相关因子在肿瘤发生、发展中的重要作用,靶向肿瘤炎症反应和炎症因子可能作为肿瘤治疗的一个新的策略,目前研究多集中在探索抗炎药物和炎性分子抑制剂与肿瘤免疫的关系。
在多项对 IL-6 或 IL-6R 抗体的Ⅰ/Ⅱ期临床试验时发现,在非小细胞肺癌、卵巢癌、前列腺癌和多发性骨髓瘤等肿瘤的治疗中,抗 IL-6 单克隆抗体西妥昔单抗表现出较好的临床效果。
研究肿瘤与炎症的相互作用不仅可以阐明肿瘤的发病机理,也为肿瘤的预防和治疗提供了新思路。抗炎症药物,如 COX-2 抑制剂、非甾体抗炎药(NSAIDs)等,可作为化学预防药降低肿瘤的发生几率。
NSAIDs 主要有水杨酸类、吡唑酮类以及乙酸类等,它们在临床前实验及临床上不同程度地抑制肿瘤的生长。
陈荣辉等研究发现,在体外实验中阿司匹林和雷公藤内酯醇不仅在单独用药时对宫颈癌细胞生长有抑制作用,而且在联合用药时对宫颈癌细胞生长有协同抑制作用,其作用机制主要与上调细胞周期阻滞因子 p21 及诱导凋亡蛋白 Bax 的表达有关。
许建华等研究表明姜黄素水杨酰单酯对急性炎症和慢性炎症模型都有明显的抑制作用,同时在体外研究中发现对白血病、淋巴瘤、胃癌、结肠癌等多种肿 瘤细胞均表现出不同程度的抑制作用,且其抗肿瘤功效优于姜黄素,在提高抗肿瘤作用的同时并没有增加药物的毒性。
以炎症微环境为靶向的药物在肿瘤治疗中的优势在于它不会使炎症细胞的正常基因组发生耐药性的突变和后发性变化,而且较少发生胃肠道并发症。尽管如此,抗炎症药物在肿瘤的治疗和预防中也存在一定局限性,大多数情况下,抗炎症的治疗并不能杀伤肿瘤细胞,需要联合杀伤肿瘤细胞的常规治 疗。而且 NSAIDs 并不是特异性的,在长期给药过程中会产生副作用,给肿瘤治疗带来一定的困难。