众所周知,目前肿瘤诊断的“金标准”是组织活检,需要从肿瘤部位提取组织标本,存在感染和内出血的风险,患者体验性较差。
液体活检,主要是对患者的血液、尿液、唾液等体液取样,检测所取体液中的肿瘤生物标志物的一项新型技术。近年来因其无创或微创的优势在各大指南中的地位迅速攀升,受到临床医师的广泛关注和研究。
液体活检主要包括循环肿瘤 DNA (ctDNA) 、循环肿瘤细胞(CTC) 、肿瘤“教育”血小板 (TEP) 和外泌体等标志物的检测。其中 ctDNA与 CTC是目前最受关注的两类液体活检靶标。
1. 循环肿瘤DNA(ctDNA)
ctDNA是来源于肿瘤组织的一种循环游离 DNA(cfDNA),通过肿瘤细胞的凋亡、坏死和分泌外泌体释放到血液中。
血液中 ctDNA 的存在及其水平的变化与肿瘤负荷和肿瘤进展有关,并且已被证实存在于多种实体恶性肿瘤患者中(如肺癌、结直肠癌、乳腺癌、黑色素瘤、前列腺癌、胃癌等)[1]。
1. ctDNA的检测
目前,实验室常用的ctDNA检测技术包括扩增受阻突变体系(ARMS)、二代测序(NGS)、数字PCR(dPCR)和核酸质谱检测等。
《液体活检在临床肿瘤诊疗应用和医学检验实践中的专家共识(2018)》推荐:
①检测患者 ctDNA 是否含有已知的、单个靶向治疗敏感或耐药型突变时,建议使用 ARMS方法。
②检测患者 ctDNA 已知的部分或全部临床药物治疗靶点谱或耐药指示靶点谱,或发现患者基因未知突变、探索临床价值与相关机制时建议使用NGS 方法。
2. ctDNA的临床应用
①早期辅助诊断:目前ctDNA已可在早期肝癌、结直肠癌、乳腺癌、胰腺癌以及肺癌患者循环中被检出,提示ctDNA对于这几种恶性肿瘤具有早期辅助诊断潜能。但需注意的一点是,特定突变例如 P53突变可在健康人群中被检出。
②指导临床用药:肿瘤精准治疗可通过检测肿瘤相应的基因信息,选择合适的靶向药物用于后续治疗,故 ctDNA检测可提供十分重要的参考信息。
美国食品药品监督管理局(FDA)批准将 ctDNA检测用于指导非小细胞癌 EGFR酪氨酸激酶抑制剂选择并写入了 NCCN指南。
③实时疗效监测:《复发/转移性乳腺癌标志物临床应用专家共识(2019年 版)》中推荐,将 ctDNA检测用于不能获取组织的晚期转移乳腺癌患者,用于治疗疗效的动态监测和管理。
④肿瘤进展及不良预后早期预警:ctDNA检测对于包括肺癌、结直肠癌、乳腺癌在内的多种实体瘤进展具有重要预警价值,可早于影像学发现复发/转移灶。这意味着通过 ctDNA检测筛选出复发/进展高风险的患者,在临床进展前可实施早期干预。
⑤耐药机制探索:ctDNA在反映靶向治疗获得性耐药中具有天然优势,通过高灵敏度方法追踪ctDNA变异情况,进而绘制肿瘤获得性耐药基因变化演进图谱有助于揭示耐药新机制,发现新的治疗靶点。但目前此领域的研究正处于起步阶段,还不足以引入临床实践。
2. 循环肿瘤细胞(CTC)
CTC是一种从实体肿瘤病灶(包含原发和转移病灶)自发脱落,或受手术操作、活检取材等外界刺激而被动脱落,以游离的单个细胞或多个细胞聚集的细胞团状态,进入外周血液系统,并循环至全身的肿瘤细胞。
目前,CTC已在许多不同的上皮细胞癌( 肺癌、乳腺癌、胰腺癌、结肠癌和前列腺癌) 和不表达上皮来源标志物的癌症( 多形性胶质母细胞瘤和黑细胞瘤) 被证实[2]。
1. CTC的检测
《液体活检在临床肿瘤诊疗应用和医学检验实践中的专家共识(2018)》推荐:临床常规检测CTC,建议各实验室选择适合自身条件的检测技术,在充分评估其检测性能后,应用于日常工作。
2. CTC的临床应用
①早期辅助诊断:近年来虽研究证实 CTC的释放是一种肿瘤早期事件,但现阶段 CTC 仍不适合单独用于肿瘤早期辅助诊断,需要更多的循证医学证据证明其价值。
②指导临床用药:CTC作为完整细胞,具有多种来源的肿瘤信息。针对 CTC的体外培养与药敏实验被证明可用于筛选靶向药物,具有巨大的临床转化潜能。但目前因技术尚不成熟及缺乏更可靠的临床依据,暂不鼓励用于临床实践。
③肿瘤进展及不良预后早期预警:CTC 检测被 FDA审批可用于预警转移性结直肠癌、转移性乳腺癌、转移性前列腺癌患者的疾病进展/不良预后。对其他实体恶性肿瘤例如恶性黑色素瘤、肝癌、胃癌等,CTC也展现出良好的预测价值。
④动态监测:
美国癌症联合会(AJCC)从第七版《肿瘤分期指南》将循环肿瘤细胞(CTC)作为癌症远处转移的指标;第八版指南中将 CTC列为乳腺癌预后评估指标。
《2019 CSCO 乳腺癌诊疗指南》指出,CTC 能够反映肿瘤组织状况,可以替代组织样本进行病理诊断、疾病监测、分子测序以及预后判断。
3. 外泌体
外泌体是表面呈凹半球状的类囊泡小体,具有立体膜结构,直径约 40~100 nm。肿瘤来源外泌体携带肿瘤特征性信息,介导肿瘤细胞间通讯、参与调节肿瘤微环境、促进肿瘤生长、转移等,展示出了在肿瘤诊断、预后、监测、转移方面潜在的应用前景。
《复发/转移性乳腺癌标志物临床应用专家共识(2019年版)》中指出,外泌体作为细胞外囊泡,包含多种组织和疾病特异的核酸或蛋白,检测外泌体内的标志物可预测乳腺癌耐药及治疗效果,未来有望成为乳腺癌液态活检的检测指标。
4. 肿瘤“教育”血小板(TEP)
血小板在人体骨髓产生后,可在血中留存 5~9天,其间可在肿瘤的影响下成为肿瘤“教育”血小板。
TEP 可成为高度实时反映肿瘤生长的 RNA表达库,有望通过准确敏感地检测 TEP及其衍生的 RNA谱,实现对肿瘤的早期诊断。
标志物检测时,体液标本的选择
液体活检时,选取的体液标本应综合考虑肿瘤来源、肿瘤部位、播散途径、以及不同体液标本的特征,综合考虑以期提高检验效率。
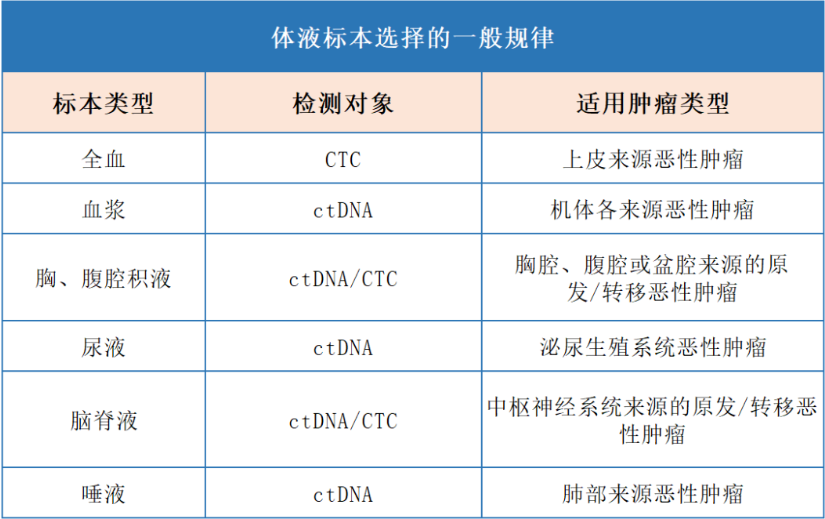
另外,标本预处理时应遵循快速、稳定的原则,针对不同标本采用不同方案进行处理,尽可能保证待测物质的稳定性和浓度,确保检测质量。
写在最后:相比于传统侵入式组织活检,液体活检具有依从性佳、标本易获取、特异性好等优势;另外还能有效克服肿瘤异质性,可有效实现精准的肿瘤辅助诊断、实时监测、疗效评价及预后判断。
液体活检虽在现阶段在临床大规模应用尚有不少挑战,但相信随着技术的不断成熟以及更多循证依据的涌现,有望成为癌症早期辅助诊断、伴随诊断、治疗监测及预后评估的理想技术,成为对抗癌种的一大“利器”!