
近年来,免疫检查点抑制剂(ICI)疗法已被证实延长了多种实体瘤患者的生存期,为肿瘤治疗提供了新的策略。靶向程序性死亡受体-1(PD-1)及其配体PD-L1是目前乳腺癌治疗领域应用最为广泛的 ICI。
乳腺癌长期以来被认为是一种免疫学上的“冷”肿瘤,且有研究发现,PD-1/PD-L1 抑制剂对实体瘤的抑制率仅为 10%~40%,这意味着有很大一部分患者并不能从免疫疗法中获益。
因此探索精准的生物疗效标志物,在接受治疗前筛选出对PD-1/PD-L1抑制剂治疗获益的患者成为乳腺癌免疫治疗领域有待解决的问题。现就PD-1/ PD-L1抑制剂在乳腺癌中的表达,应用及不良反应进行总结!
一、PD-1/PD-L1在乳腺癌中的表达
多项研究报道 PD-1 和 PD-L1 在乳腺癌患者中的表达状况。
Gatalica 等[2]的研究表明,PD-1 和 PD-L1 在三阴性乳腺癌(TNBC)和 HER2 阳性乳腺癌中表达率更高;
Sabatier 等[3]研究显示,PD-L1 在乳腺癌细胞中的表达阳性率为 20%~30%,且根据乳腺癌分型的不同具有异质性,其表达与患者低龄、肿瘤体积大、肿瘤级别高等呈正相关;
而 Ali 等[4]在3916例乳腺癌患者中发现,肿瘤组织中6%(235/3 916)的免疫细胞表达 PD-L1,仅有 1.7%(66/3916)的肿瘤细胞表达 PD-L1, 由此推测在乳腺癌中少见 PD-L1 的表达。
此外,越来越多的研究者认为 PD-L1 的表达与乳腺癌的预后有关。
Kim 等[5]的研究显示,在HER2阳性乳腺癌中,肿瘤细胞PD-L1的过表达与高组织学分级和高肿瘤浸润淋巴细胞水平相关,且PD-L1在肿瘤细胞中的表达可能是HER2阳性乳腺癌预后的积极因素。
Zhang 等[6]对2546例乳腺癌病例进行的meta分析显示,PD-L1 的过表达与乳腺癌患者的高危临床病理参数有关,且可预测乳腺癌患者的预后;
Yuan 等[7]通过检测47例浸润性乳腺癌伴同侧腋窝淋巴结转移患者PD-1/PD-L1的表达,发现PD-1在肿瘤组织和腋窝淋巴结中的表达是一致的,而PD-L1在转移性淋巴结中的表达明显高于原发肿瘤,且与不良预后特征(如高Ki-67指数、高TNM分期等)显著相关,推测肿瘤细胞可能借助上调 PD-L1 来逃避免疫系统的监视,从而转移到区域淋巴结。
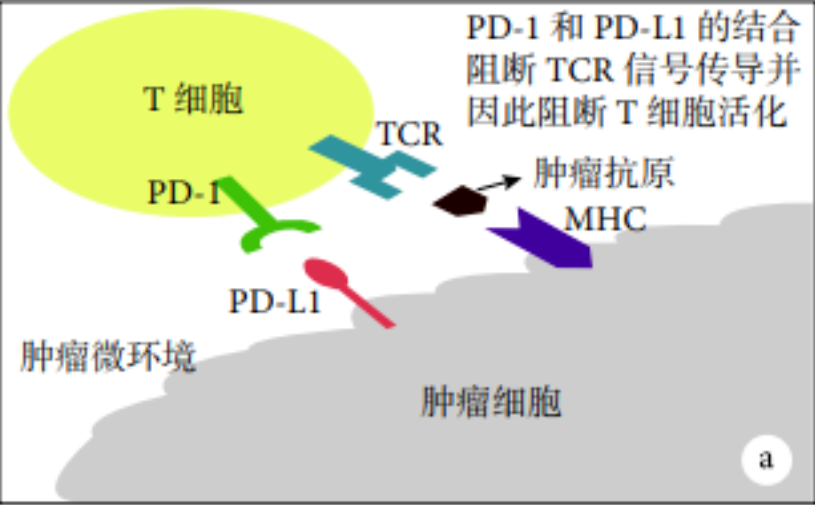
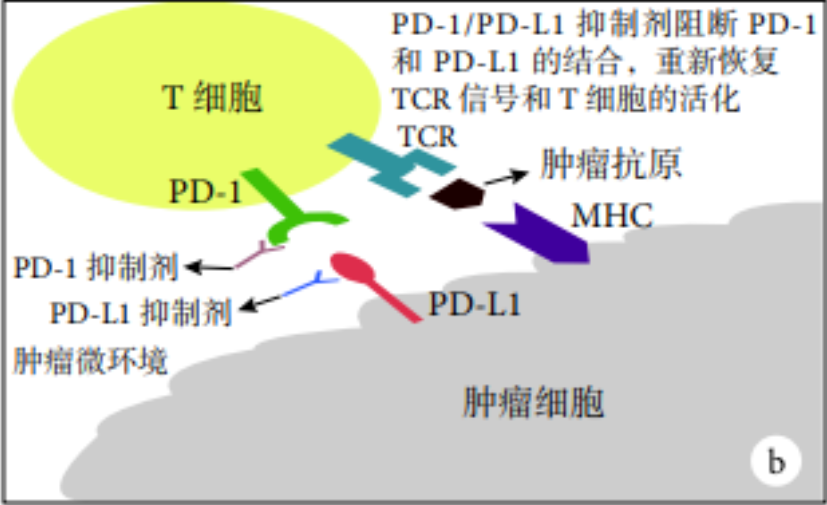
a:肿瘤细胞通过在其细胞表面表达PD-L1来抑制T细胞活化;b:PD-1/PD-L1抑制剂通过特异性地与PD-1/PD-L1结合而重新激活T细胞
PD-1/PD-L1 抑制剂作用机制示意图
二、PD-1/PD-L1抑制剂在乳腺癌中的应用
PD-1 和 PD-L1 单抗药物已被 FDA 批准用于转移性黑色素瘤、非小细胞肺癌(NSCLC)等的治疗,有关乳腺癌的免疫治疗多处于临床研究阶段。
目前 FDA 批准临床可用的 PD-1 单克隆抗体有帕博利珠单抗、纳武利尤单抗、西米普利单抗,PD-L1 单克隆抗体有阿替利珠单抗、阿维鲁单抗、度伐利尤单抗。
1、单药治疗
KEYNOTE-012临床试验是第一个成功证明 PD-1 抑制剂帕博利珠单抗单药治疗复发或转移性TNBC有效性的多中心、非随机Ⅰb期临床试验,采用帕博利珠单抗2周疗法(10 mg/kg,静脉注射),在能够进行肿瘤活性评估的27例TNBC患者中总缓解率(ORR)达18.5%。
Ⅱ期 KEYNOTE-086 研究将转移性三阴性乳腺癌(mTNBC)分为2个队列,队列A共纳入170例既往接受过≥1次转移性疾病治疗的mTNBC 患者, 进行为期2年的帕博利珠单抗3周疗法(200 mg,静脉注射),治疗后的ORR为5.3%,PD-L1阳性人群中为5.7%,在总体人群和 PD-L1 阳性人群中的疾病控制率(DCR)分别为 7.6% 和 9.5%;队列B将帕博利珠单抗作为 84 例 PD-L1 阳性 mTNBC 患者的一线治疗(每3周静脉注射200 mg,持续 2 年),ORR 为 21.4%,DCR 为 23.8%。
该研究结果提示,在 PD-L1 阳性 mTNBC 患者的一线治疗或在一部分曾接受治疗的 mTNBC 患者中帕博利珠单抗单药疗法都具备持久的抗肿瘤活性及安全性。
2、联合治疗
PD-1/PD-L1抑制剂单药治疗对肿瘤负荷不重的转移性三阴性乳腺癌(TNBC)是有效的。然而,在肿瘤进展和高转移性肿瘤负荷的患者中,单药 PD-1/PD-L1抑制剂的疗效并不令人满意。
化疗被认为可以增加患者对 PD-1/PD-L1 抑制剂的抗癌反应。 紫杉醇类药物具有激活Toll样受体的能力,尤其是增加DC活性。因此,有研究开始关注PD-1/PD-L1 抑制剂与化疗药物的联合治疗,以期能提高临床疗效。
首个研究免疫疗法联合化疗的IMpassion130 研究发现,阿替利珠单抗联合白蛋白紫杉醇的方案能明显改善 TNBC 患者的无进展生存期(PFS),意向性治疗患者及 PD-L1 阳性患者均能从中获益。
这项研究使 FDA 批准了阿替利珠单抗联合化学疗法治疗 PD-L1 表达阳性、既往未行化疗控制转移性疾病的不能手术的局部晚期或转移性 TNBC 成人患者,此治疗组合成为乳腺癌中首个获批的癌症免疫治疗方案。
Deng 等发现,高剂量电离辐射(IR)介导肿瘤细胞不可逆性死亡,且PD-L1 在 IR 后的肿瘤微环境中表达增加,提示PD-1/PD-L1 抑制剂联合放疗有效。
一项关于乳腺癌新辅助治疗的 I-SPY2 临床研究于 2020 年美国癌症研究协会(AACR)上公布的最新数据显示,在纳入试验组的73例Ⅱ/Ⅲ期高危 HER2 阴性乳腺癌患者(其中21例为HR阴性,52例为HR阳性且经 MammaPrint 评分评估为高复发风险患者)的新辅助化疗中加入度伐利尤单抗和多聚腺苷二磷酸核糖聚合酶抑制剂可显著提高其病理完全反应率(pCR)。对于HER2阳性乳腺癌患者,免疫治疗联合其他疗法同样获益。
PANACEA 研究中 PD-L1 阳性患者的ORR为 15%,提示对于 PD-L1 阳性表达的HER2阳性乳腺癌患者帕博利珠单抗联合曲妥珠单抗治疗安全且具有临床效益。
三、PD-1/PD-L1抑制剂治疗相关副作用
与目前临床常用的抗肿瘤细胞毒药物副反应不同,大多数情况下,免疫治疗相关的药物不良反应较轻。免疫检查点抑制剂相关不良反应通常是可控的,可以短暂使用免疫抑制剂处理,并且不影响其抗肿瘤作用。
1、皮肤
免疫检查点抑制剂治疗中最常见的是皮肤不良反应,其表现多样,典型的是斑丘疹、皮肤红斑伴或不伴瘙痒,一般累及躯干和四肢。其他皮肤不良反应包括:荨麻疹、白癜风、掌趾红斑。
皮疹等轻度不良反应可以通过外用糖皮质激素和口服抗组胺药物来缓解。3~4级皮肤不良反应罕见,如中毒性表皮坏死松解症,一旦发生,则须立即停止免疫检查点抑制剂治疗,并给予相应处理。
2、胃肠道
腹泻/结肠炎通常见于免疫检查点抑制剂开始治疗后6周,发生率约为10%~20%。
症状早期可表现为水样或血性腹泻、腹痛、发热,体重下降,恶心或呕吐。严重病例应静脉注射糖皮质激素,静脉输液以维持水电解质平衡。
3、肝脏
肝炎通常出现于免疫检查点抑制剂开始治疗后8~12周,见于约5%的患者,通常无症状,主要是1级和2级,3、4级罕见。影像学表现不典型,严重情况下CT可能发现轻度肝肿大、肝门水肿或周围淋巴结肿大征象。
治疗以糖皮质激素为主;罕见情况下伴有天门冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)升高的激素难治性肝炎,给予500mg/12h的吗替麦考酚 酸酯(MMF)可能有效。
4、内分泌
内分泌系统副反应涉及肾上腺、垂体和甲状腺,通常表现为非特异性症状,如恶心、头痛、疲劳等。其中垂体和甲状腺功能减退症最常见,发生率约为10%。
垂体炎临床表现为头痛、乏力,影像学检查可以有垂体强化、增大的表现,血生化检查可见促肾上腺皮质激素(ACTH)、促甲状腺激素(TSH)、生长激素(GH)等下降。但应注意与原发性肾上腺功能减退和原发性甲状腺功能减退鉴别。
治疗包括糖皮质激素,出现继发性甲状腺功能减退或肾上腺皮质功能减退时,宜及时给予激素替代治疗。肾上腺危象可以导致脱水、血压下降和电解质紊乱,必须尽快给予处理,包括大量水化及静脉注射皮质类固醇并积极预防感染。
5、呼吸系统
肺炎的发生率小于10%,咳嗽、气短等症状为非特异性,必要时行影像学检查;中重度病例在进行免疫抑制剂治疗前应行支气管镜检查以除外传染性疾病。
治疗包括大剂量的甲强龙(2mg/kg),必要时可以应用其他免疫抑制剂如环磷酰胺。
6、其他
红细胞再生障碍性贫血、中性粒细胞下降、获得性血友病、血小板减少也曾有报道。其他罕见的不良反应,如:葡萄膜炎、胰腺炎、肾功能不全也有报道。
写在最后:免疫治疗可以通过重塑肿瘤微环境和刺激抗肿瘤免疫反应来改善该亚型患者的预后。近年来,PD-1/PD-L1 抑制剂在乳腺癌免疫治疗中的应用已逐渐成为一种重要的治疗方案 。
然而乳腺癌的免疫治疗研究还存在下列重要的科学问题,包括目前尚无公认的生物标志物来精准确认免疫治疗敏感人群;联合治疗的机制尚未明确,需要更多的分子水平研究来找出联合治疗的机制,以探索更好的联合治疗方案;目前的临床证据不足以确定术后佐剂、新佐剂或序贯治疗疗效及序贯治疗的给药顺序;如何能避免或降低 irAE 的发生率等有待继续深入研究。
