结直肠癌(CRC)是全世界发病率最高的癌症之一。2022 年中国和美国的结直肠癌确诊病例数分别为 59.22 万例和 16.02 万例,分别占该年新增癌症确诊病例的 12.3% 和 6.8%。
胆固醇参与细胞膜的构成,可维持细胞膜的完整性和膜内物质的稳定性,其在合成、摄取、转化及分解等代谢过程中所产生的细胞因子及活性物质共同参与细胞内及细胞间信号的传导,不仅调控正常细胞周期的转化,同时与癌症的代谢重编程有关。
本文将介绍胆固醇结构与功能、代谢基本途径及其在 CRC 代谢中的作用,一起来学习!
01
胆固醇的结构与功能
胆固醇作为一种 27 碳多环脂质分子,广泛存在于哺乳动物细胞膜中,主要依赖于甾醇转运蛋白来维持自身的分布及构象。
由胆固醇参与形成的膜基本构架在细胞运动及代谢过程中可充当信号传导的载体—“脂筏”。这种脂筏所支撑的跨膜信号传导与肿瘤血管形成、上皮-间充质转化及癌症转移密切相关,潜在地奠定了肿瘤发生受胆固醇代谢调控的分子基础。

02
胆固醇代谢的基本途径
胆固醇内源性生物合成是一项复杂的高耗能过程,其中主要转录调节因子甾醇调节元件结合蛋白(SREBP)及两种限速酶 3-羟基-3-甲基戊二酰辅酶 A 还原酶(HMGCR)和角鲨烯环氧酶(SQLE)发挥着关键作用。
SREBP 包括 SREBP1 和 SREBP2 两种亚型,其中 SREBP2 能够编码多种胆固醇合成酶基因,是调控胆固醇生物合成的关键亚型。
在胆固醇缺乏的状态下,SREBP2 能够与 SREBP 裂解激活蛋白(SCAP)结合形成SREBP2-SCAP 复合物,该复合物经由内质网向高尔基体的活化转运后进入细胞核,并与其靶基因启动子中的甾醇调节元件(SRE)相结合来启动甲羟戊酸途径。随后,由 SREBP2 编码转录的 HMGCR 在还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的协助下将羟甲基戊二酰辅酶 A(HMG-CoA)还原成甲羟戊酸,然后依次经异戊二烯化及 SQLE 环 氧化反应完成甲羟戊酸-角鲨烯-羊毛甾醇的过渡,最后经多步骤氧化、去甲基化及还原反应形成胆固醇。
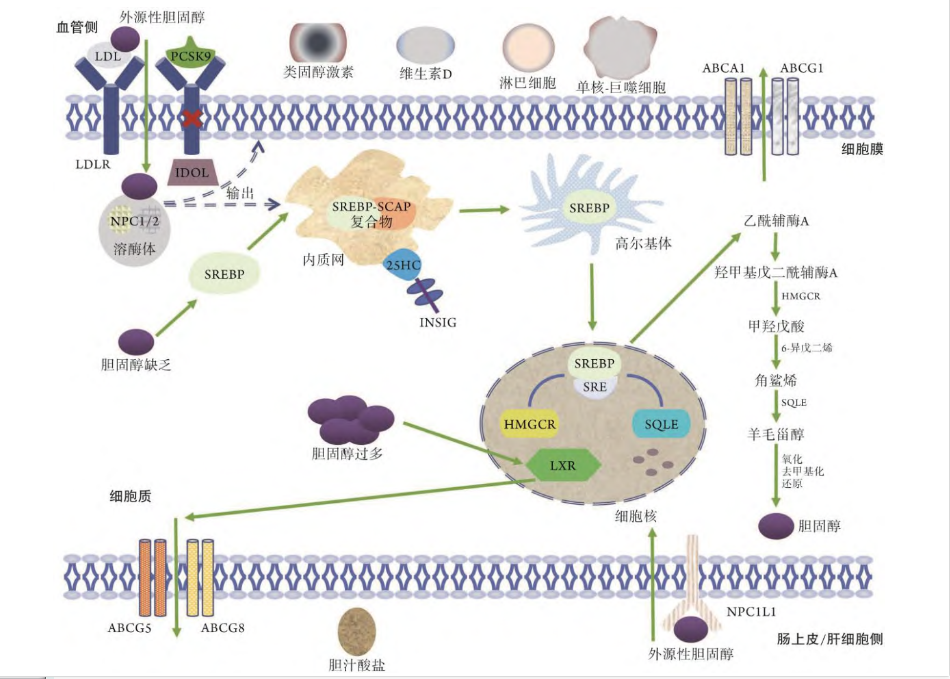
胆固醇代谢信号机制:ABCA1. ATP 结合盒亚家族成员 A1;ABCG1. ATP 结合盒亚家族成员 G1;ABCG5. ATP 结合盒亚家族成员 G5;ABCG8. ATP 结合盒亚家族成员 G8;SREBP. 甾醇调节元件结合蛋白;25HC. 25 羟基胆固醇;INSIG. 胰岛素诱导基因编码的内质网蛋白;SCAP. SREBP 裂解激活蛋白;NPC1/2. Niemann-Pick C1/2 蛋白;LDL. 低密度脂蛋白;LDLR. 低密度脂蛋白受体;PCSK9. 前蛋白转化酶枯草杆菌素 /kexin9 型;IDOL. 肌球蛋白调节轻链互作蛋白;SQLE. 角鲨烯环氧酶;NPC1L1. 跨膜蛋白 Niemann-Pick C1-like 1;SRE. 甾醇调节元件;HMGCR. 3-羟基-3-甲基戊二酰辅酶 A 还原酶;LXR. 肝脏 X 受体
除内源性合成外,胆固醇还可经肝细胞小管膜与肠上皮细胞顶膜上的跨膜蛋白尼曼-匹克 C1 型类似蛋白 1(NPC1L1)直接进行外源性摄取。
细胞内富余的胆固醇既可储存在脂滴中,也可与血浆中其他脂蛋白结合被运输回肝脏分解并被代谢为胆汁酸盐,从而参与消化吸收或转化为类固醇激素及维生素 D 来调节内分泌状态。然而,当细胞内胆固醇水平偏高时,肝脏 X 受体(LXR)则作为胆固醇稳态传感器负责驱动胆固醇外流并减少其合成,以平衡细胞内胆固醇浓度。
03
胆固醇代谢参与 CRC 的调控
充足的能量供应及稳定的信号调控是维持肿瘤生长的关键前提,尽管目前尚未发现任何一种物质能够彻底氧化胆固醇,但胆固醇代谢通路中的甲羟戊酸反应参与肿瘤编程的内在机制已被证实。
在肿瘤细胞中,胆固醇的异常代谢往往表现为其合成或摄取水平增高、代谢酶活性上调或缺失以及衍生物异常聚积等,这些都可能通过重塑肿瘤微环境来参与肿瘤细胞的增殖与转移。以下重点介绍胆固醇代谢途径中相关衍生物、调节蛋白以及免疫细胞在 CRC 发病及进展中的信号机制。
一、胆固醇代谢途径中相关衍生物及调节蛋白对 CRC 的调控
1、25HC/27HC
最新研究显示,胆固醇的氧化衍生物 25-羟基胆固醇(25HC)能够作为中间体嵌合在 SREBP-SCAP 与 INSIG 蛋白之间以介导 SREBP 的活化,负责调节胆固醇的生理代谢。
25HC 在 CRC 中往往被视为一种抑癌因素。一项研究结果表明,25HC 对 CRC 的抑制可能与 SREBP2 的表达沉默有关,因为癌细胞的增殖活力可通过诱导 SREBP2 上调后恢复。
胆固醇的另一类衍生物 27-羟基胆固醇(27HC)在 CRC 的信号传导中表现出双重效应:27HC 既可通过活化 Akt 以促进促血管物质如血管内皮细胞生长因子、 基质金属酶及多种炎性因子的释放,且这种活化效应仅表现在晚期 CRC 的扩散阶段;同时还可直接靶向抑制 Akt 来阻止有丝分裂以抑制 CRC 细胞的克隆与迁移,最终导致两种截然相反的临床结局。
2、SREBP
胆固醇调节元件结合蛋白(SREBP)是位于内质网的细胞内胆固醇敏感器,对细胞内胆固醇进行反馈调节。
有研究表明,当胞质内胆固醇水平偏高时,SREBP1 明显上调而 SREBP2 呈绝对下降趋势,SREBP1 介导的胆固醇积累能够增高辐射条件下 CRC 细胞的存活率,由此推测,SREBP1 可能与 CRC 辐射抗性及耐药表达有关,可作为 CRC 患者调控放疗敏感性的靶点。SREBP2 在 CRC 细胞中接受反馈调节的同时可能以促 PIM3 活化的形式促进肿瘤增殖。
3、HMGCR/SQLE
HMG-CoA还原酶(HMGCR)是由887个氨基酸残基组成的糖蛋白,存在于肝脏、肠道及其他组织的内质网。
HMGCR 除受 SREBP2 的直接编码转录外,其结构中嵌有一个甾醇感应域(SSD)负责感应胆固醇浓度,当胞质内胆固醇水平偏高时,INSIG 蛋白与 HMGCR 上的 SDD 相结合并诱导其发生降解,进一步阻止胆固醇合成。
在 CRC 中 SQLE 促胆固醇合成的同时也受胆固醇的降解调控,并与糖原合成激酶-3β(GSK-3β)及抑癌基因的表达失活有关。在针对 SQLE 靶向用药上尚存在将 CRC 诱导向更差表型的风险,而联合降胆固醇药物及 SQLE 抑制剂可能是一种潜在有效的治疗策略。
4、LXR
LXR 是转录因子核受体超家族的成员,包括 LXRα 和 LXRβ 两种亚型,其通常被细胞内氧甾醇作为配体激活,功能上可促进全身细胞内胆固醇的逆向消除并抑制胆固醇再摄取。
在 CRC 中,LXRα 上调可激活多种膜通道蛋白介导胆固醇外流,并通过抑制 S 期激酶相关蛋白 2(SKP2)的表达使肿瘤细胞分裂阻滞在 G1 期;同时动物实验证实,使用 LXRα 激动剂诱导后小鼠成瘤体积更小,数量更少,具有明显的抑瘤效能。
5、LDLR
LDLR 广泛存在于各类细胞表面,在每次完成胆固醇酯的内吞后,其会依赖于胞质内 pH 重新返回细胞表面,形成再循环内吞机制以提升胆固醇的转运效率。
有研究发现结肠肿瘤标本中LDLR 在肿瘤形成的初始阶段可能通过增加炎癌转化的风险来增加致瘤性。CRC 细胞表面 LDLR 的上调与淋巴转移及远处转移风险呈正相关(P<0.05),提示 LDLR 可能是预测 CRC 不良预后的生物标志物。
二、免疫细胞中异常胆固醇代谢对 CRC 的调控
1、淋巴细胞与胆固醇
淋巴细胞是参与构建机体免疫屏障的关键活性细胞,可通过释放穿孔素和 颗粒酶等多种活性物质在抗肿瘤免疫中发挥作用。胆固醇介导的X-box 结合蛋白 1可能作为调节 CD8+ T 细胞免疫活性的重要靶点。
肠屏障微生态的维持离不开肠黏膜中淋巴细胞的浸润,其中,表达转录因子蛋白 RORγ 的调节性 T 细胞受来自饮食或肠道的因子共同调控,并被认为与肠黏膜炎症反应有关。
肠道内胆固醇代谢产物初级胆汁酸在肠黏膜免疫稳态的维持中发挥着重要作用。研究显示,少量进入结肠的胆汁酸经肠道内微生物修饰后可能通过与维生素 D 受体相互作用而稳定 RORγ+ Tregs 的分布并建立起稳固的肠黏膜免疫屏障,从而减少炎症刺激以降低结肠黏膜炎癌转化的风险。
因此,增加结肠内胆固醇代谢产物胆汁酸的含量对于肠屏障功能的构建及维持具有促进意义。
2、单核-巨噬细胞与胆固醇
胆固醇能够刺激巨噬细胞(TAM)释放趋化因子配体 5 并促进 p65 蛋白及信号转导转录激活子 3 的发生核转位,从而上调癌细胞表面程序性死亡蛋白配体1。
单核-巨噬细胞所产生的IL-1β 是一种促炎和促癌因子,已被证实与 CRC 的不良预后有关。
胆固醇能够阻断巨噬细胞中腺苷单磷酸活化蛋白激酶的活化而导致线粒体大量产生,并通过激活炎症小体 NLRP3 以诱导 IL-1β 持续释放,增加结直肠黏膜炎症与癌症的发生风险。
04
总结
近年来,从癌细胞代谢微环境角度理解癌症的发展是较为热门的研究方向,因为癌细胞总是利用各种途径创造出适合自身发展的微环境以满足其庞大的代谢需求。
胆固醇在多种癌症尤其是 CRC 的重编程机制中发挥着明显的作用。在胆固醇代谢过程中如 25HC/27HC、SREBP、 HMGCR、SQLE、LXR、LDLR 以及肿瘤相关免疫细胞(如淋巴细胞、单核-巨噬细胞等)不断受到肿瘤因素的干扰, 并接受多因素的共同调控而展现出相当复杂的机制。
积极关注并研究这些靶点在 CRC 中的作用机制是开展胆固醇靶向治疗的关键,有望为靶向胆固醇治疗 CRC 提供新方向。