
类器官这项1980年代出现的概念沉寂了三十余载,直到近十年才迎来飞速发展。其应用前景远比我们想象的广阔,从精准医疗、疾病建模、药物筛选到再生医学,都是这个“迷你器官”所能发挥价值的领域。
现阶段,类器官技术用于肿瘤伴随诊断已取得不错成果,在肩负患者精准诊疗重任的道路上有望越走越远。同时,随着动物保护主义呼声不断、实验动物价格水涨船高,类器官及器官芯片替代动物试验势在必行,引发众多跨国制药巨头及投资机构的关注。美国在2022年发布FDA Modernization Act 2.0,取消新药临床前进行动物实验的强制要求,并推荐了以类器官技术为代表的非动物的检测手段。同年,全球首款完全基于类器官芯片获得临床前数据的新药进入临床。
类器官与器官芯片的革新时代已来,本文将详述该技术的诞生、应用价值、市场潜力与格局、技术面临的挑战、以及如何寻求突破。
什么是类器官?
类器官(Organoids)一词最早出现于上世纪80年代的学术论文中,这项技术直到2009年才迎来快速发展。类器官是指利用成体干细胞(ASC)或多能干细胞(PSC)进行体外3D培养,形成类似体内器官结构和功能的“微器官模型”,是对早期2D培养细胞的技术革新。2D细胞培养由于无法实现细胞间交流或细胞与细胞外基质的相互作用,存在应用的局限性。类器官培养突破这一难题,高度模拟原始器官的结构,甚至一定程度还原其过滤、排泄、神经链接、收缩功能等。
2009年是类器官技术元年,荷兰科学家Hans Clevers成功从LGR5+的小肠干细胞中培养出了小肠类器官。随后研究不断深入,多种类器官被成功培养,并广泛覆盖各个实体瘤癌种。Hans Clevers成立的Hubrecht Organoid Technology (HUB)是类器官最早的研发中心,HUB技术授权促进了Epistem、Cellesce、Crown Biosciences、STEMCELL Technologies在内的一批类器官公司的涌现。
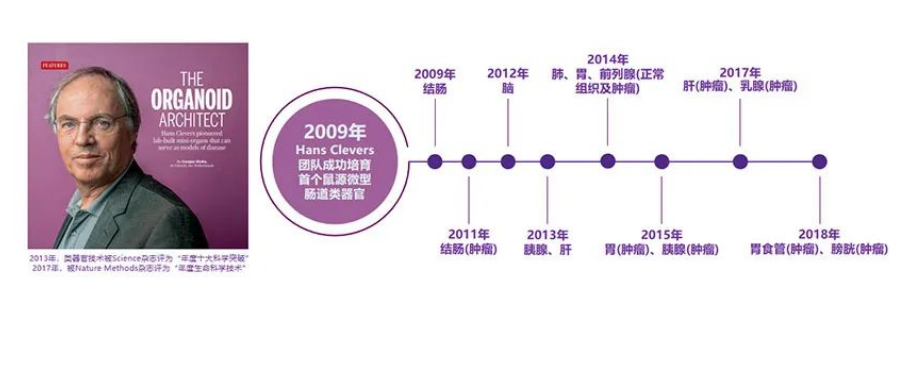
类器官技术经过十余年的发展,目前广泛用于癌症患者的个体化用药指导、基础科研、药物开发等。
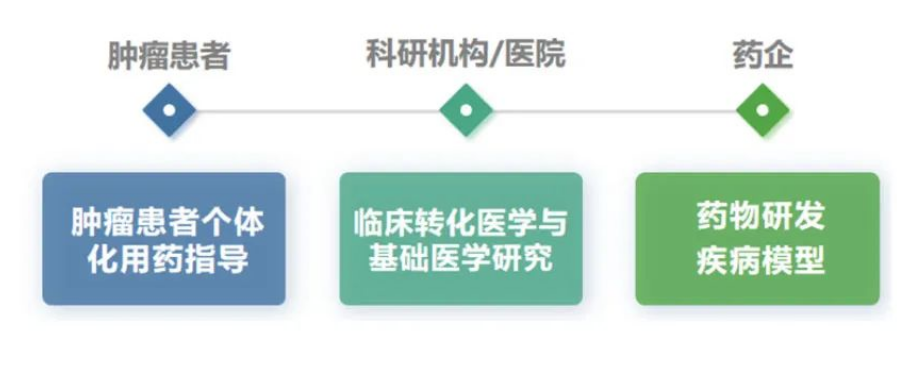
肿瘤类器官,
为患者“替身试药”
肿瘤类器官(PDO)顾名思义,即体外3D培养的“迷你肿瘤”,主要用于对肿瘤患者的个体化用药指导(即肿瘤伴随/补充诊断)。2021年,全球新增肿瘤患者逾2,000万,我国占比20%;国际癌症研究机构(IARC)预计2070年全球新发3,400万例肿瘤患者。如何快速选择适合自身的治疗药物是患者最迫切的需求,以便尽可能抓住黄金救治时间、减少不必要的药物开支。据研究机构估算,全球肿瘤伴随诊断市场规模约60亿美元,并以20%的CAGR增长。
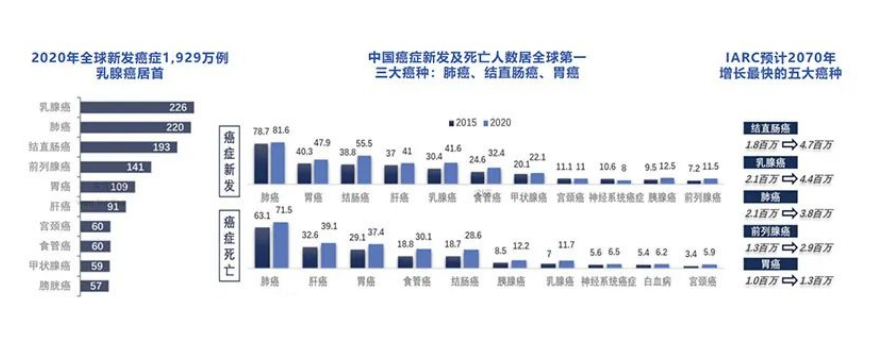
全球肿瘤患者数量
PDO的细胞来源主要是成体干细胞(ASC),通常来自于肿瘤患者的活检组织,培养体系较多能干细胞(PSC)简单。因其技术成熟、取材简单、建模周期快捷,最适合为患者“替身试药”。随着全球老龄化加剧、医疗技术进步、以及抗癌药物推陈出新,肿瘤伴随诊断将成为广大患者的刚性需求。
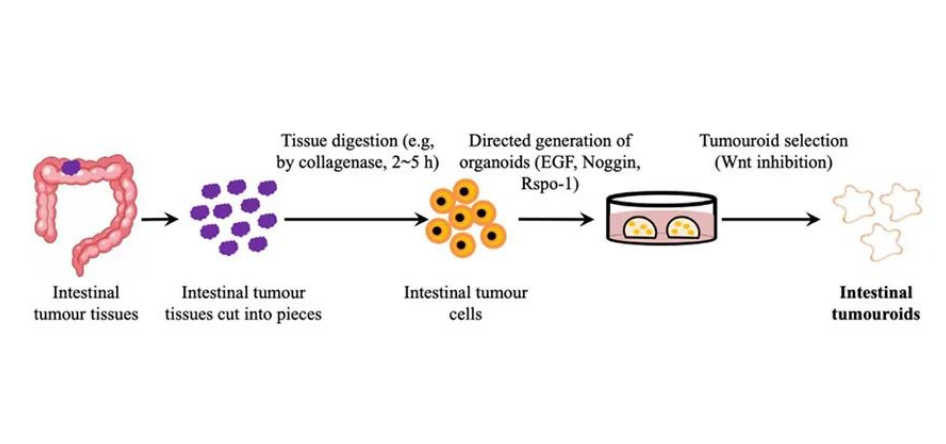
肠道肿瘤类器官的培养流程
PDO在肿瘤伴随诊断领域不得不让人感叹“宛宛类NGS”,两种技术各有千秋,两相结合可优势互补。二代基因测序(NGS)在生殖筛查、肿瘤伴随诊断方面已取得深远发展。根据燃石招股书,我国NGS肿瘤伴随诊断市场在2030年有望达到300亿元规模,年复合增速35%。但NGS存在检测盲点、无法覆盖化疗药等弊端,且对发生耐药后的筛药能力有限。另外,癌症的最大特点——肿瘤异质性,会导致同癌种同分期分子分型的不同患者所需用药方案并不相同,正所谓“没有完全相同的两片树叶”,可见定制化用药方案对癌症患者的巨大价值。PDO评测化疗药的优势更加显著,尤其针对晚期转移、出现耐药的患者更具有药物筛选价值,有效应对肿瘤异质性问题,真正做到1v1个体化用药指导。也正因此,Hans Clevers将类器官定义为Next Generation Diagnosis(NGD)。
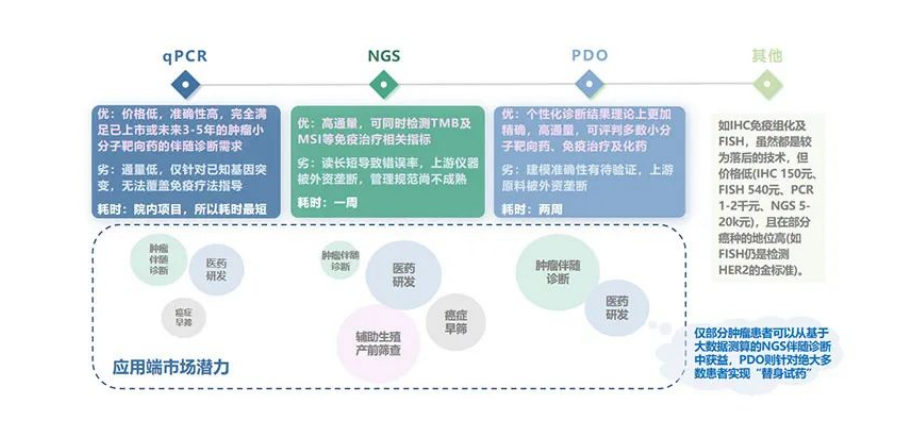
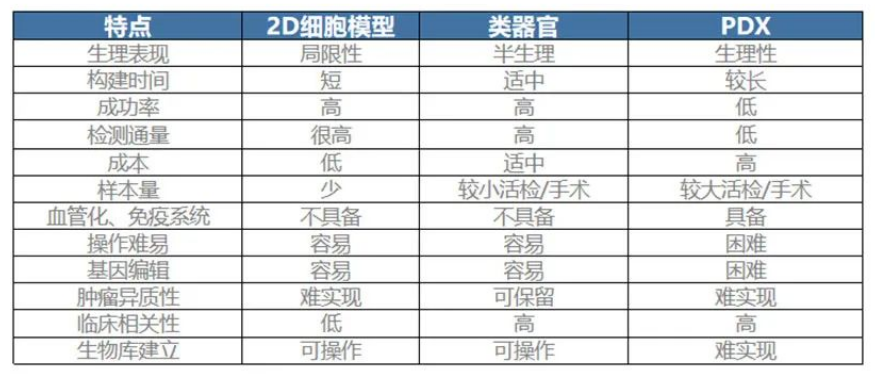
肿瘤伴随诊断领域各技术对比
不过,由于活检组织一般仅含有器官的上皮部分,缺乏基质、神经和血管系统,PDO目前还无法预测抗VEGR类药物。随着血管化甚至神经化构建、以及PSC培养技术的成熟,PDO未来有望覆盖更多药筛种类。另外,微流控芯片、CRISPR-Cas9、iPSC等前沿技术的加持,让类器官有可能无限趋近于人体,从而完成从动物实验的“补充”转为“替代”。
替代动物实验,
类器官还有多远?
2022年,美国参众两院先后批准了美国食品药品监督管理局现代法案2.0 (FDA Modernization Act 2.0),取消新药临床前进行动物实验的强制要求,推荐了一些非动物的检测手段,包括类器官、细胞模型、器官芯片和微生理系统、计算机模型等。
《Nature》利用类器官成功筛选出新冠治疗候选药物
动物实验一直以来都是颇具争议的话题,此法案推行除了出于动物保护的目的,实验动物短缺及价格飞涨也是原因之一。根据FDA调查数据,一款新药的平均研发周期约10年、耗资约10亿美元,而进入临床开发阶段的新药失败率近90%。随着食蟹猴价格在过去一年迅速飙升20倍,叠加全球经济下行引发的融资难局面,降低新药的研发成本并提升临床前研发胜率势在必行。据统计,动物试验费用约6500~80万美元(尚未计入动物研究机构的饲养动物费用)。欧洲器官芯片协会测算,在肝毒性研究中器官芯片的实验成本是动物实验的10%。此外,部分科学家在更深度的解读人类基因组和蛋白质后,开始质疑人类与动物试验模型在药理学上的相关性是否强到让动物实验成为必选项。类器官技术还有望加速罕见病药物的研发,据统计全球7000多种罕见病中仅有400种开启药物研发,主要原因就是缺乏适合的动物模型。
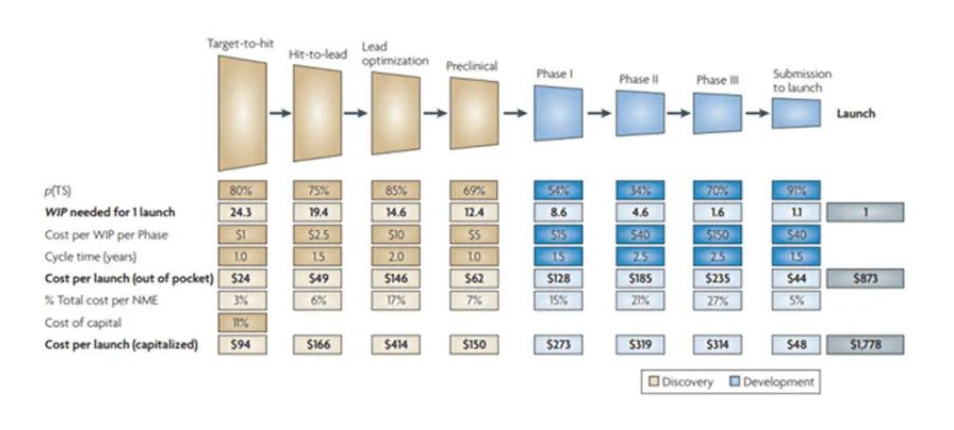
开发新药的研发成本模型
(来源:Steven M. Paul et al., How to improve R&D productivity: the pharmaceutical industry's grand challenge)
类器官较传统小鼠模型拥有通量高、速度快、成本低、临床相关性强等优势,在欧美已获得诸多政策支持。跨国巨头默克自2020年起将逐步取消动物试验,目前已利用类器官、器官芯片等技术测试化合物对软骨的影响,并与以色列公司库里斯在预测性人工智能技术方面合作。
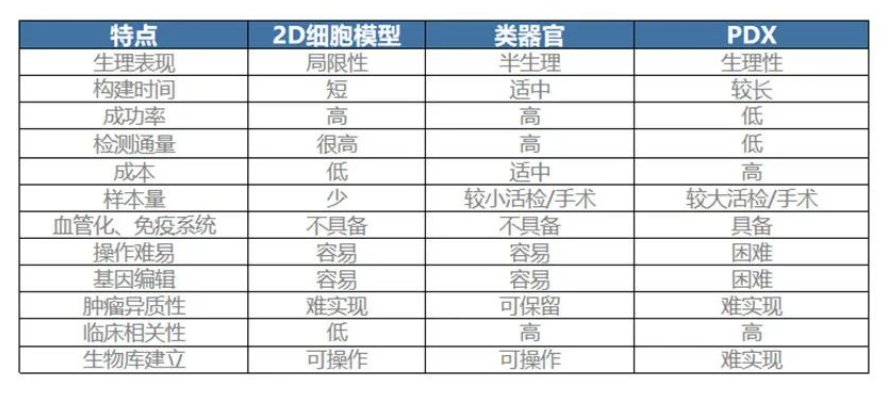
注:PDX模型是将取自患者的肿瘤组织植入实验小鼠,建模成本高昂(约30万元)、耗时久(3-6个月)。
开发新药的研发成本模型
(来源:Steven M. Paul et al., How to improve R&D productivity: the pharmaceutical industry's grand challenge)
类器官无论从哪种维度,都被视为动物模型的最佳补充/替代。目前全球实验动物市场规模约180亿美元,其中生物制药用途的规模109亿元。北美地区是全球最大的实验动物市场,弗若斯特沙利文预测我国的动物模型市场未来几年复合增速约28%,远高于全球增长。而类器官所面临血管化、神经化、以及微环境构建问题,也在通过各种前沿技术寻求解决方案。
注:PDX模型是将取自患者的肿瘤组织植入实验小鼠,建模成本高昂(约30万元)、耗时久(3-6个月)。
类器官无论从哪种维度,都被视为动物模型的最佳补充/替代。目前全球实验动物市场规模约180亿美元,其中生物制药用途的规模109亿元。北美地区是全球最大的实验动物市场,弗若斯特沙利文预测我国的动物模型市场未来几年复合增速约28%,远高于全球增长。而类器官所面临血管化、神经化、以及微环境构建问题,也在通过各种前沿技术寻求解决方案。
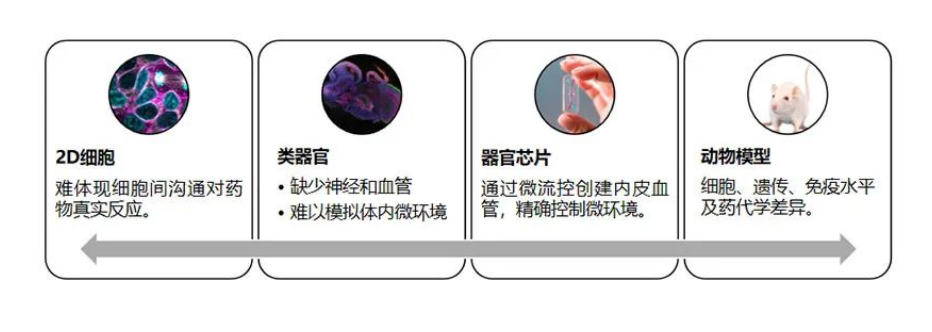
1)器官芯片(OOC):类器官与微流控芯片的“医工结合”
器官芯片是由光学透明的塑料、玻璃或柔性聚合物等构成的微流控细胞培养设备,包括由活细胞组成的灌注空心微通道,通过体外重建组织器官水平的结构功能,再重现体内器官的生理和病理特征。器官芯片在类器官的基础上,更加有效的模拟药物代谢、器官之间的相互作用。
器官芯片完美诠释FDA微生理系统概念
如下图中的肺器官芯片,是目前模拟肺部体外生理功能的最优模型,其上下两层被生物膜所分开。上层为肺细胞,流通的是空气;下层为肺毛细血管细胞,流通的是培养液。两边为真空侧室,通过循环吸力来使得两侧的真空通道进行伸缩,从而带动膜上细胞的收缩,实现传统培养皿不可能实现的呼吸功能。

器官芯片的核心技术之一微流控,是指精确控制微量流体,甚至创建浓度梯度,利用微流体技术使营养物质和其它化学信号以可控的方式运动和传递,可构建和模拟人体组织微环境。美国NIH、FDA和国防部曾在2011年牵头推出 “微生理系统” 计划,把器官芯片技术的开发和应用上升到国家战略层面。
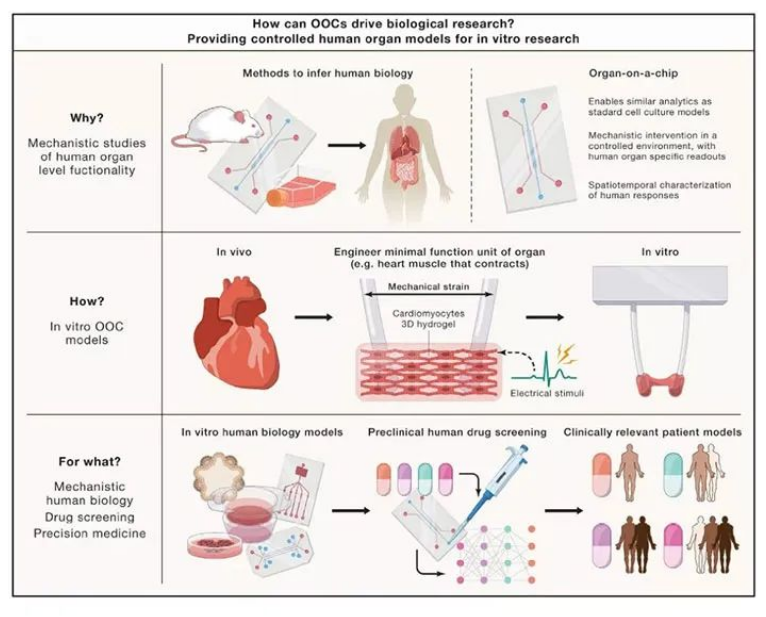
来源:Vunjak-Novakovic, et al., (2021). Organs-on-a-chip models for biological research. Cell
微流控芯片的常用材料包括PDMS(聚二甲基硅氧烷)、玻璃、硅、PMMA等。PDMS材料无毒透明、成本低廉,但存在非特异性地吸收小分子的问题。玻璃和硅材料可达纳米级加工精度,但成本较高。目前学界已围绕各种热塑性塑料展开相关探索,如聚氨酯、环烯烃聚合物和共聚物等。
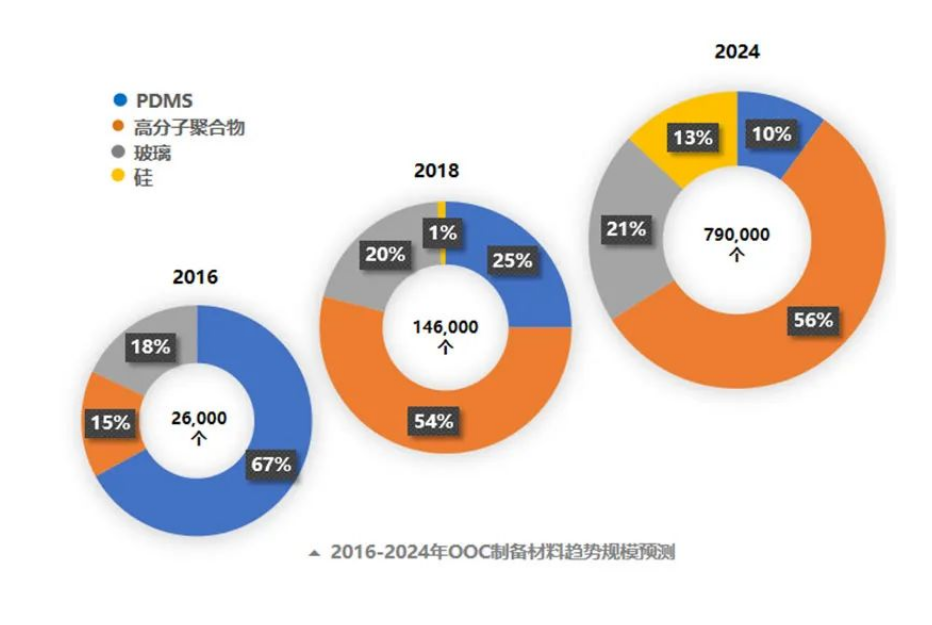
来源:Organs-on-Chips Market and Technology Landscape 2019
2) CRISPR-Cas9:丰富取样途径、探索病变过程
CRISPR-Cas9允许研究者通过基因编辑正常的类器官模型获得样本,不再局限于从不同发育阶段的肿瘤组织中取样。通过基因编辑技术还可以研究哪些基因或者基因组参与了肿瘤形成和发展,对基础科研及新药研发有巨大价值。如美国约翰·霍普金斯大学医学院曾在GEJ类器官模型上,通过CRISPR-Cas9技术敲除了两个关键肿瘤抑制基因,发现会导致加速癌变。
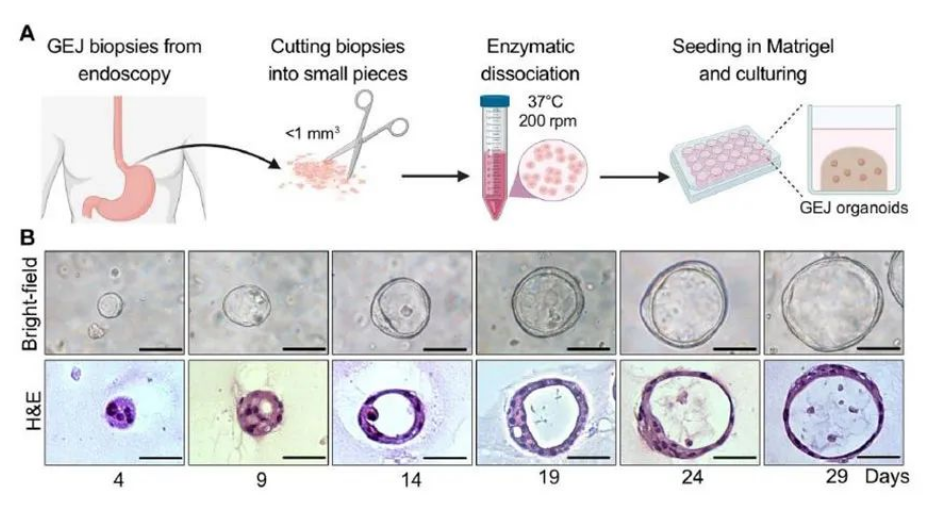
来源:Generation and multiomic profiling of a TP53/CDKN2A double-knockout gastroesophageal junction organoid model, Science Translational Medicine
3)iPSC:拓展类器官应用范围,支撑血管化及神经化构建
诱导性多能干细胞(iPSC)由日本科学家山中申弥团队在2006年提出,该技术于2012年获得诺贝尔奖。iPSC具备胚胎干细胞(ESC)的诸多优势(如分化及增殖能力强、免疫排异小、易规模化等),同时不涉及伦理道德问题。iPSC因为极强的分化能力大大拓展了类器官的应用范围,科学家曾在2013年利用iPSC分化成人类大脑类器官,更有研究者开始探索类器官在难度极大的中枢神经系统(CNS)疾病的应用。血管化研究一直是类器官领域的难题,多国科学家已尝试利用iPSC诱导成血管内皮细胞、特异的动脉类器官等。
我国面临的挑战与应对措施
我国类器官与器官芯片技术起步较晚,目前面临的最大挑战是缺乏成熟的行业标准。类器官技术用于肿瘤患者的精准医疗服务,最重要的评价指标是与体内样本的相似度及临床疗效符合度,虽然已出台首部专家共识,但产业发展仍处于早期培育阶段。类器官技术用于新药研发的前提是保证模型的有效性、传代培养的稳定性等,需要达到一定的标准化程度及样本数据量,药企才会放心利用新技术替代动物实验。
如果类器官行业能够在多方努力下形成标准,积累更多具备临床价值的样本数据,并进一步纳入诊疗指南及医保,类器官技术将获得更多药企及大众客户的认可,从而实现在精准医疗与新药研发的多种领域的商业化拓展。
推动行业成熟发展的要素
2021年起我国出台一系列政策推动类器官产业发展。国家科技部把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务,提出类器官技术在未来将有非常大的应用价值和发展前景。
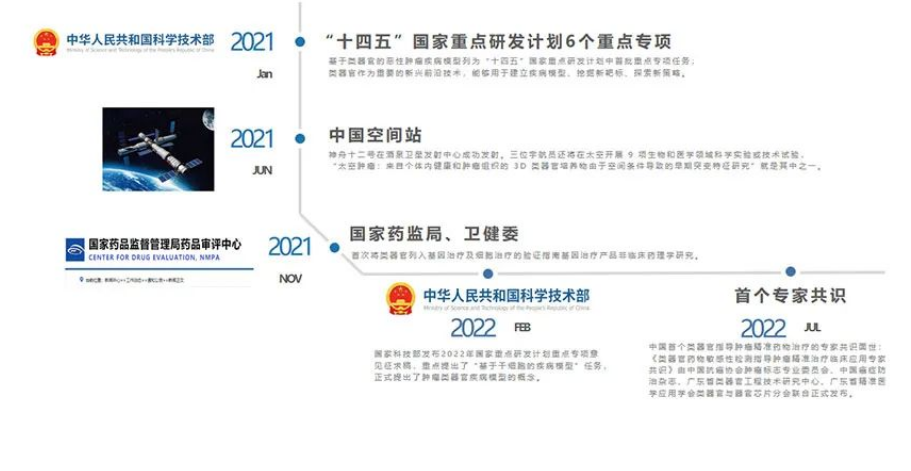
我国高度重视类器官行业发展
另一挑战是上游原料被海外垄断,导致当前类器官建模成本较高。培养类器官需要基质胶等支持介质、成体干细胞等组织来源、以及细胞因子等生长耗材。细胞培养基质作为关键原料被美国BD Bioscience的产品Matrigel®垄断,细胞因子供应也被Stemcell、赛默飞等海外巨头占据。寻求上游国产替代是降本增效的关键,比如使用来自天然材料的水凝胶支架替代传统基质胶。

类器官产业链
写在最后
毋庸置疑,类器官技术的问世具有划时代意义。2021年,类器官作为“培养皿中的宇航员”被送往「天宫号」空间站,进入浩瀚的太空。如同人类探索神秘的宇宙一般,类器官也将在科技进步的长河中奋力前行,寻求医疗创新的更多可能,赋予人类掌控自己生命走向的权力。
